Enlace Iónico (metal + no metal)
¿Qué es el enlace iónico?
Es el enlace que se da entre elementos de electronegatividades muy diferentes. Se produce una cesión de electrones del elemento menos electronegativo al mas electronegativo y se forman los respectivos iones positivos (los que pierden electrones) y negativos (los átomos que ganan los electrones).
Este tipo de enlace suele darse entre elementos que están a un extremo y otro de la tabla periódica. O sea, el enlace se produce entre elementos muy electronegativos (no metales) y elementos poco electronegativos (metales).
¿Qué mantiene la unión?
La fuerza de atracción entre las cargas positivas y las cargas negativas que se forman; es decir, la fuerza de atracción entre los cationes y los aniones.
¿Se forman moléculas?
No, se forman redes cristalinas (ordenadas). Por tanto, los iones que se forman con este enlace no forman moléculas aisladas sino que se agrupan de forma ordenada en redes en las que el número de cargas positivas es igual al de cargas negativas, compuesto es neutro.
La fórmula que habitualmente se da es una formula empírica.
* Propiedades
Temperaturas de fusión y ebullición muy elevadas. Sólidos a temperatura ambiente. La red cristalina es muy estable por lo que resulta muy difícil romperla.
Son duros (resistentes al rayado).
No conducen la electricidad en estado sólido, los iones en la red cristalina están en posiciones fijas, no quedan partículas libres que puedan conducir la corriente eléctrica.
Son solubles en agua por lo general, los iones quedan libres al disolverse y puede conducir la electricidad en dicha situación.
Al fundirse también se liberan de sus posiciones fijas los iones, pudiendo conducir la electricidad.
Enlace Covalente (no metal + no metal)
¿Qué es el enlace covalente?
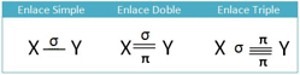
Es el enlace que se da entre elementos de electronegatividades altas y muy parecidas, en estos casos ninguno de los átomos tiene más posibilidades que el otro de perder o ganar los electrones. La forma de cumplir la regla de octeto es mediante la compartición de electrones entre dos átomos. Cada par de electrones que se comparten es un enlace.
Este tipo de enlace se produce entre elementos muy electronegativos (no metales).
Los electrones que se comparten se encuentran localizados entre los átomos que los comparten.
¿Qué mantiene la unión?
La fuerza de atracción entre las cargas positivas de los núcleos y las cargas negativas de los electrones que se comparten.
¿Se forman moléculas?
Tenemos moléculas como tales en el caso de las sustancias moleculares. Si los átomos que se unen con enlace covalente forman 'sólidos covalentes' o 'redes covalentes', no tendremos moléculas como tales entidades que se puedan aislar.
Propiedades.
Son las habituales de los enlaces covalentes:
- Temperaturas de fusión bajas. A temperatura ambiente se encuentran en estado gaseoso, líquido (volátil) o sólido de bajo punto de fusión.
- La temperaturas de ebullición son igualmente bajas.
- No conducen la electricidad en ningún estado físico dado que los electrones del enlace están fuertemente localizados y atraídos por los dos núcleos de los átomos que los comparten.
- Son muy malos conductores del calor.
La mayoría son poco solubles en agua. Cuando se disuelven en agua no se forman iones dado que el enlace covalente no los forma, por tanto, si se disuelven tampoco conducen la electricidad.
Enlace Metálico (metal + metal)
¿Qué es el enlace metálico?
Es el enlace que se da entre elementos de electronegatividades bajas y muy parecidas, en estos casos ninguno de los átomos tiene más posibilidades que el otro de perder o ganar los electrones. La forma de cumplir la regla de octeto es mediante la compartición de electrones entre muchos átomos. Se crea una nube de electrones que es compartida por todos los núcleos de los átomos que ceden electrones al conjunto..
Este tipo de enlace se produce entre elementos poco electronegativos (metales).
Los electrones que se comparten se encuentran deslocalizados entre los átomos que los comparten.
¿Qué mantiene la unión?
La fuerza de atracción entre las cargas positivas de los núcleos y las cargas negativas de la nube de electrones.
* Propiedades
Temperaturas de fusión y ebullición muy elevadas. Son sólidos a temperatura ambiente (excepto el mercurio que es líquido).
Buenos conductores de la electricidad (nube de electrones deslocalizada) y del calor (facilidad de movimiento de electrones y de vibración de los restos atómicos positivos).
Son dúctiles (facilidad de formar hilos) y maleables (facilidad de formar láminas) al aplicar presión. Esto no ocurre en los sólidos iónicos ni en los sólidos covalentes dado que al aplicar presión en estos caso, la estructura cristalina se rompe.
Son en general duros (resistentes al rayado).
La mayoría se oxida con facilidad.